El primer trasplante de órganos del mundo se realizó en 1954. Se trató de un riñón procedente del hermano gemelo de un paciente. En 1965, el cirujano Josep María Gil-Vernet llevó a cabo el primer trasplante de un órgano en España, en el Hospital Clinic de Barcelona. Fue un trasplante renal obtenido de un cadáver. Estos procedimientos han mejorado continuamente y además las comunidades han ido alineando sus necesidades y criterios éticos de forma tal de garantizar los procesos transparentes de acceso a los órganos donados.
La pandemia COVID-19 ha tenido un impacto profundo en todos los países en términos de salud, desarrollo social y desarrollo económico. No menos ha sido el impacto sobre los programas de donación y trasplante en todo el mundo. Mantener estas actividades, como reflexiona Beatriz Domínguez-Gil, MD, PhD, directora de la Organización Nacional de Trasplantes, en el Newsletter Trasplant, ha supuesto un verdadero desafío.
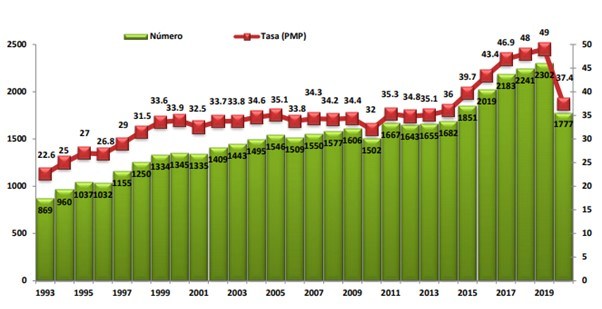
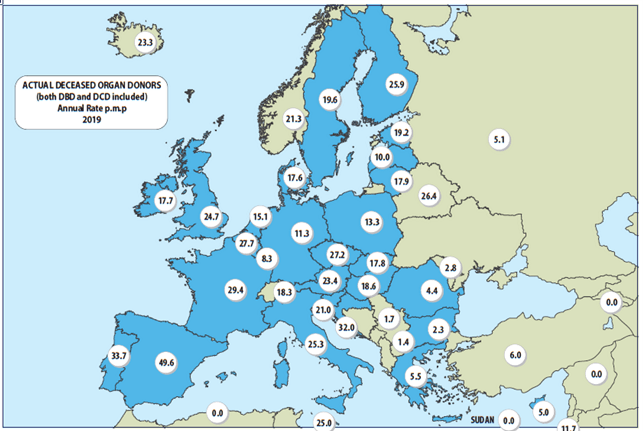
España es el país de la Unión Europea con mayor número de donantes de órganos, y si bien la actividad ha estado sometida a un crecimiento constante, como puede confirmarse a través del informe anual de la Organización Nacional de trasplantes (Figura 1), durante el 2020, con el surgimiento de la pandemia COVID-19, el impacto fue notable y las consecuencias a mediano y largo plazo aún merecen una valoración.
¿Cómo se puede compensar este impacto negativo? Aumentando la eficacia y eficiencia en el proceso de forma tal de aumentar la viabilidad de los órganos a ser donados, mejorando la supervivencia del órganos en el receptor y reduciendo el porcentaje de rechazo.
La tecnología médica contribuye a alcanzar este objetivo, prolongando las características vitales de los órganos y aumentando la supervivencia del paciente trasplantado. Actualmente existen distintas metodologías para la preservación de órganos y tejidos, como son la preservación in situ, la preservación ex vivo, la criopreservación o el superenfríamiento (-4ºC).
La inversión tecnológica impacta directamente en este proceso si ponemos foco en las máquinas de preservación de órganos que prolongan el tiempo de isquemia fría. Este se trata de un tiempo vital, porque puede producirse demoras en el traslado del órgano de un centro a otro, tal como ha ocurrido durante la pandemia COVID-19, que ha obligado a contemplar tiempos más prolongados de traslados debido a la incorporación de nuevas medidas en los protocolos existentes.
Como ya habían indicado Juan José Rubio en su trabajo “Reflexiones sobre la donación en asistolia controlada”, la correcta técnica de preservación y extracción de órganos puede influir favorablemente en la evolución del órgano trasplantado.
Por ejemplo, el método tradicional para el almacenamiento del hígado consiste en depositarlo en hielo tras su obtención, lo que reduce su actividad metabólica y permite su almacenamiento durante 12-18 horas. Investigadores del Hospital Universitario de Zurich y del EHT desarrollaron un dispositivo que permite conservar los hígados metabólicamente activos ex-vivo durante una semana, cuando hasta ahora la tecnología médica permitía conservarlos un día. Este nuevo desarrollo abre la puerta a la posibilidad de incluir trasplantes que hasta la fecha no contemplaban, gracias a la perfusión normotérmica. Se ha demostrado en pruebas de laboratorio que este método permite también reparar lesiones preexistentes, limpiar depósitos de grasa y regenerar algunas partes en hígados de baja calidad. Podemos anticipar que la perfusión abdominal normotérmica podría convertirse en una buena forma de mejorar e incluso aumentar el número de órganos disponibles para trasplantes.
Por otro lado, existen una gran variedad de grupos investigadores y áreas de desarrollo que buscan mejorar la calidad de vida de los pacientes trasplantados y aumentar el porcentaje de éxito evitando o reduciendo las complicaciones habituales derivadas del trasplante o del rechazo al órgano por parte del huésped. Para ello se ha estado impulsando el desarrollo de biomarcadores que permiten supervisar el desarrollo de fibrosis; microsensores para detectar isquemias de forma fiable o para controlar la vascularización del tejido trasplantado.
Asimismo, otros laboratorios han explorado vías para comprender los mecanismos activados en el paciente receptor que promueven el rechazo del órgano trasplantado, como, por ejemplo, los de inmunidad entrenada, de forma tal de encontrar medios para prevenir la aparición de estos mecanismos.
¿Qué más esperar para el futuro? Entre los posibles soluciones podemos pensar en nuevos retos que ya no forman parte de relatos de ciencia ficción como la elaboración de órganos a través del propio tejido del paciente, lo que asegura una compatibilidad total con el receptor o la terapia celular adoptiva que implica la trasfusión de células inmunes que induzcan tolerancia en el paciente.
Referencias
DOI: 10.1016/j.medin.2016.04.003 – Reflexiones sobre la donación en asistolia controlada (donantes tipo III de Maastricht) – J.J. Rubioa, D. Palaciosb
NEWSLETTER TRANSPLANT International figures on donation and transplantation 2019 – EDQM Volume 25 2020
Memoria actividad donación y trasplante. España 2020 – Organización Nacional de Trasplantes
http://www.madrimasd.org/
http://www.ont.es/